Thapar, A. (2018). Discoveries on the genetics of ADHD in the 21st century: New findings and their implications. American Journal of Psychiatry, 175(10), 943-950. https://doi.org/10.1176/appi.ajp.2018.18040383
Este posibil să existe erori și neconcordanțe în această traducere în ceea ce privește terminologia medicală și generală. Opiniile expuse de către acest articol NU îmi aparțin în mod necesar. Este posibil să existe prezent limbajul patologizant, datorită contextului medical.
Rezumat
Secolul 21 a fost martorul descoperirii mai multor variante genetice rare și comune asociate cu tulburarea hiperactivă cu deficit de atenție (ADHD), iar aceste descoperiri au oferit deja un punct de plecare pentru investigarea biologiei tulburării și a tratamentelor inovatoare. Scopul acestei recenzii selective este de a examina descoperirile genetice din ultimii 5 ani și de a lua în considerare implicațiile acestora pentru conceptualizarea ADHD și practica clinică viitoare. Descoperirile recente dezvăluie suprapuneri genetice puternice între ADHD și tulburarea spectrului autist (TSA) precum și dizabilitatea intelectuală. Astfel, eliminarea criteriilor anterioare de excludere diagnostică pentru ADHD în prezența TSA este o schimbare binevenită în DSM-5.
Cu toate acestea, ADHD-ul prezintă, de asemenea, corelații genetice substanțiale cu un grup mult mai larg de tulburări neuropsihiatrice precum și cu condiții nepsihiatrice (de exemplu, cancer pulmonar). Investigarea explicațiilor potențiale pentru aceste legături este un pas important următor. ADHD, deși este util să fie conceptualizat ca o tulburare în practica clinică, poate fi văzut ca un trăsătură. Descoperirile recente ale studiului de asociere genomică largă, în concordanță cu studiile pe gemeni, subliniază că ADHD se află la capătul extrem al unei dimensiuni distribuite în mod continuu, asemănător hipertensiunii de-a lungul continuumului tensiunii arteriale.
Deși nivelurile ADHD scad în mod tipic odată cu vârsta, studiile genetice pe gemeni și moleculare sugerează că o traiectorie persistentă este asociată cu o încărcătură genetică mai mare. Testarea de rutină pentru mutații rare în ADHD nu este încă recomandată, deși ghidurile din multe țări recomandă testarea persoanelor cu dizabilitate intelectuală ușoară sau TSA, astfel practica s-ar putea schimba. Variantele genetice comune pentru ADHD sunt doar slab predictive și, prin urmare, au o valoare clinică limitată în prezent, la fel ca farmacogenomica.
Noiembrie 1938: Analize electroencefalografice (EEG) ale copiilor cu probleme de comportament
Electroencefalograma a fost prima tehnică biologică aplicată tulburărilor comportamentale din copilărie. Jasper, Solomon și Bradley au raportat că
„electroencefalograma a reușit să dezvăluie o anormalitate definită a funcției cerebrale în peste jumătate dintr-un grup de tulburări comportamentale ale copilăriei care anterior erau considerate în mare parte psihogene.”
(American Journal of Psychiatry 1938; 95:641–658)
Conceptul de tulburare hiperactivă cu deficit de atenție (ADHD) ca o condiție clinică poate fi urmărit încă dinainte de secolul 20 (1). Viziunea că comportamentele asociate cu ADHD provin din „leziuni cerebrale timpurii” a rămas foarte influentă pe parcursul unei mari părți a secolului 20 până când prima serie de studii pe familii și gemeni (2) a dezvăluit indirect contribuția factorilor de risc genetic. În secolul 21, avansurile tehnologice și eforturile colaborative la scară largă au permis investigații genetice directe și reușite în tulburările neuropsihiatrice, inclusiv ADHD (3). ADHD, ca toate condițiile medicale comune, nu este explicat doar de gene; riscurile de mediu contribuie, de asemenea (pentru o discuție completă despre factorii de risc de mediu și designurile pentru testarea cauzalității, vezi referința 2).
Acest articol este o recenzie selectivă și conceptuală, scopul căreia este de a lua în considerare descoperirile genetice despre ADHD din ultimii 5 ani și implicațiile lor pentru conceptualizarea ADHD și practica clinică viitoare. Rațiunea acestei abordări a fost că există deja recenzii cuprinzătoare și sistematice publicate despre genetica ADHD care acoperă literatura care precede această perioadă (de exemplu, 2, 4).
Natura neurodezvoltativă a ADHD-ului
Este cunoscut de decenii că ADHD este familial și foarte ereditabil (5), cu estimări ale ereditabilității în intervalul 60%-90%. Studiile pe gemeni au arătat o suprapunere genetică puternică cu alte psihopatologii ale copilăriei, cel mai proeminent cu problemele de comportament, cum ar fi tulburarea de conduită (6). Într-adevăr, ADHD a fost mult timp considerat în principal o problemă de externalizare sau comportamentală (7). Cu toate acestea, studiile genetice mai recente au evidențiat natura sa neurodezvoltativă (8), iar aceste descoperiri au adăugat la argumentele clinice că ADHD se comportă ca o tulburare neurodezvoltativă. ADHD, la fel ca tulburarea spectrului autist (TSA) și dizabilitatea intelectuală, precum și alte tulburări neurodezvoltative ale copilăriei, are de obicei debut precoce, tinde să arate un curs clinic constant mai degrabă decât unul care remite și recidivează, și este frecvent însoțit de deficite neurocognitive timpurii (8).
Suprapunerea familială cu autismul și dizabilitatea intelectuală
Studiile recente naționale pe baza registrelor de familie și gemeni au permis investigarea diagnosticelor mai degrabă decât a trăsăturilor și au dezvăluit o suprapunere familială și genetică puternică între ADHD și TSA. Într-un studiu suedez (9), co-gemenii monozigoți ai persoanelor cu TSA au fost găsiți să aibă un risc crescut de ADHD (raportul de șanse=17.77, IC 95%=9.8–32.22) comparativ cu co-gemenii dizigoți (raportul de șanse=4.33, IC 95%=3.21–5.86). Aceste asocieri au fost cele mai proeminente pentru persoanele cu TSA cu funcționare mai înaltă decât pentru cei cu TSA cu funcționare scăzută (cu dizabilitate intelectuală). Deși suprapunerea în cadrul individului și în cadrul familiei a ADHD și TSA este acum acceptată, până la publicarea DSM-5, un diagnostic de ADHD în prezența autismului a fost interzis.
Descoperirile genetice recente au provocat, de asemenea, reticența istorică privind diagnosticarea ADHD la persoanele cu dizabilitate intelectuală și includerea celor cu IQ scăzut în studiile genetice. A fost întotdeauna recunoscut că ADHD este puternic asociat cu un IQ scăzut și dizabilitate intelectuală (10). Studiile pe populația de gemeni privind IQ-ul și abilitatea de învățare (de exemplu, abilitatea de citire) au constatat în mod consecvent că cea mai mare parte a corelației cu simptomele ADHD a fost explicată de ereditabilitatea partajată (10). Interesant, deși suprapunerile genetice între dizabilitatea intelectuală și autism (11) și între dizabilitatea intelectuală și schizofrenie sunt bine recunoscute (12), investigațiile privind legăturile genetice între dizabilitatea intelectuală și
ADHD au fost rare. Un studiu recent de familie bazat pe registre a abordat această lacună examinând diagnosticul ADHD și dizabilitatea intelectuală (13). Autorii au constatat că cea mai mare parte a corelației între ADHD și responsabilitățile dizabilității intelectuale a fost explicată de factorii genetici (estimată la 91%) cu excepția cazului de dizabilitate intelectuală profundă. Din nou, aceste descoperiri subliniază natura neurodezvoltativă a ADHD și sunt importante pentru oamenii de știință și clinicieni. Istoric, deși persoanele cu IQ scăzut sau dizabilitate intelectuală au fost excluși din studiile despre ADHD, acest lucru nu a fost cazul pentru studiile despre schizofrenie și autism. Acest lucru înseamnă că studiile de cercetare despre ADHD, inclusiv investigațiile de descoperire a genelor, cu unele excepții (14), nu au inclus întregul spectru IQ. Dacă persoanele cu ADHD care au comorbiditate cu dizabilitate intelectuală sau TSA sunt excluși din studiile genetice, aceasta este o problemă potențială, deoarece înseamnă că astfel de investigații nu vor fi fost pe deplin reprezentative pentru populația clinică sau incluzând persoanele cel mai grav afectate.
Descoperiri Genetice și Implicațiile lor pentru Conceptualizarea ADHD
Cu avansurile tehnologice, reducerea costurilor și colaborările la scară largă, astfel încât dimensiunile foarte mari ale eșantioanelor sunt disponibile, cercetătorii au putut investiga diferite clase de variație genetică pe întregul genom. Studiile timpurii de legătură și asociere au dezvăluit că ADHD, ca și alte tulburări neuropsihiatrice, este în cele mai multe cazuri o tulburare multifactorială. Nu este explicată de moștenirea mendeliană sau variantele genetice comune de dimensiune mare a efectului. Studiile genetice moleculare recente despre ADHD au arătat că este foarte poligenic; adică, arhitectura sa genetică este explicată de mii de variante genetice comune, fiecare cu dimensiunea efectului mic (raportul de șanse tipic, <1.1) (15), precum și de mutații rare, unele dintre care au o dimensiune a efectului mult mai mare (de exemplu, duplicarea cromozomului 16p13.11, raportul de șanse=13.88, IC 95%=2.3–82.2) (14).
Mutatii genetice Rare de dimensiuni mari ale efectului care influențează ADHD și alte tulburări neurodezvoltative
Sindroame stabilite
Un număr de tulburări mendeliene rare și anomalii cromozomiale sunt însoțite de ADHD precum și de alte tulburări neurodezvoltative și neuropsihiatrice. De exemplu, ADHD este cea mai comună tulburare neuropsihiatrică observată în sindromul de ștergere 22q11.2 (16), chiar dacă acest sindrom este considerat în mod tipic în principal un factor de risc pentru psihoză. ADHD este, de asemenea, asociat cu scleroza tuberoasă, sindromul Smith-Magenis, sindromul X fragil și sindromul Prader-Willi. Cu toate acestea, aceste tulburări duc la o gamă largă de fenotipuri neurodezvoltative și neuropsihiatrice dincolo de ADHD, inclusiv TSA, anxietate și depresie, și sunt adesea însoțite de dizabilitate intelectuală și anomalii fizice; niciuna dintre aceste mutații cunoscute nu este specifică pentru ADHD.
Variante de număr de copii
În ultimul deceniu, au existat eforturi crescânde, prin investigații sistematice pe întregul genom, de a identifica noi mutații genetice rare asociate cu ADHD și alte tulburări neuropsihiatrice (3). O clasă de mutații rare, cunoscute sub numele de variante de număr de copii (CNV), care sunt segmente de cromozom care sunt duplicate sau șterse, au fost implicate în tulburări care ar putea fi considerate mai neurodezvoltative în natură decât, de exemplu, tulburarea depresivă majoră sau multe tulburări de anxietate. Acestea includ dizabilitatea intelectuală, autismul, schizofrenia și, mai recent, sindromul Tourette, precum și ADHD (3, 14, 17–21). Regiunile genomice acoperite de CNV-urile asociate cu ADHD s-au dovedit a avea o suprapunere semnificativă cu CNV-urile implicate în autism și schizofrenie, evidențiind efectul foarte pleiotropic al CNV-urilor. Ciudat, nimeni nu a investigat încă suprapunerea cu CNV-urile implicate în dizabilitatea intelectuală încă.
Variante de secvență
Cea mai mare și singura investigație sistematică a unei alte clase de mutații rare în ADHD, variantele rare de secvență exom, este o analiză încă nepublicată a 3,536 de persoane cu ADHD din studiul danez iPSYCH bazat pe registre (22). Investigatorii au observat o povară a variantelor rare de truncare a proteinelor (PTV) în ADHD similară cu cea găsită în TSA, și ambele grupuri au fost îmbogățite pentru PTV-uri peste rata observată în grupul de control neafectat (rapoartele de șanse, 1.24 pentru ADHD și 1.23 pentru TSA). Deși ratele substanțial mai mari de PTV-uri au fost observate la cei cu dizabilitate intelectuală comorbidă, în concordanță cu rezultatele dintr-un studiu anterior despre povara CNV (19), a fost găsită o povară semnificativă de PTV-uri rare la persoanele cu ADHD care nu aveau dizabilitate intelectuală comorbidă. Intrigant, acești autori au constatat că genele afectate de variantele rare ale ADHD și TSA erau de nedistins.
Variante genetice comune: Dimensiuni mici ale efectelor partajate asupra ADHD-ului și altor tulburări și trăsături neurodezvoltative
Descoperirile GWAS ale ADHD până în prezent
Dimensiuni foarte mari ale eșantionului sunt necesare pentru a detecta variantele genetice comune individuale folosind designurile de studiu de asociere genomică largă (GWAS), și până de curând acestea au lipsit pentru ADHD. Cu toate acestea, cel mai recent GWAS al ADHD, care a inclus 20,183 de cazuri de ADHD și 35,191 de controale, a implicat robust 12 loci genetici independenți (15), inclusiv unul care conține gena FOXP2, care a fost implicată anterior în probleme severe de vorbire și limbaj (23). Având în vedere că niciunul dintre locii semnificativi la nivel genomic nu conținea vreuna dintre genele candidate anterior implicate în ADHD (de exemplu, genele dopaminergice), această literatură anterioară nu este discutată în continuare. Este posibil ca dovezi care implică unele dintre aceste gene să apară cu eșantioane GWAS mai mari, deoarece dimensiunile efectelor sunt mici și GWAS-urile ADHD rămân insuficient alimentate, deci este prea devreme să respingem aceste constatări. Cu toate acestea, este important între timp să rămânem precauți față de constatările anterioare ale genelor candidate și studiile care le utilizează.
Diferențe de sex
Bărbații sunt afectați mai frecvent de ADHD, iar aceasta este o caracteristică a tulburărilor neurodezvoltative ale copilului. Studiile anterioare bazate pe frați sugerau că femeile cu ADHD pot purta o povară mai mare de risc genetic pentru ADHD, și aceasta ar fi o explicație potențială pentru de ce bărbații sunt mai frecvent afectați (de exemplu, deoarece femeile trebuie să poarte o povară mai mare de risc pentru a manifesta tulburarea). Cu toate acestea, astfel de constatări nu par să fie explicate de factorii genetici comuni dezvăluiți de cel mai recent GWAS (24).
Suprapunerea ADHD-ului cu autismul
Datele GWAS pot fi, de asemenea, utilizate pentru a investiga corelațiile genetice între două tulburări sau trăsături diferite. Ciudat, și în contrast cu constatările studiilor pe familie și gemeni, studiul trans-tulburare al Consorțiului Internațional de Genomica Psihiatrică publicat în 2013 (25) nu a găsit nicio suprapunere genetică între ADHD și TSA. În contrast, în GWAS-ul danez național iPSYCH al TSA, încă nepublicat și mult mai mare, autorii au observat o corelație genetică semnificativă de 0.36 între ADHD și TSA chiar și atunci când persoanele cu ambele tulburări au fost excluși (26). Explicația probabilă este că noul GWAS iPSYCH este mult mai mare și, prin urmare, mai bine alimentat.
Din perspectiva descoperirilor genetice recente, ADHD se comportă ca o tulburare neurodezvoltativă tipică, cu o povară mai mare de mutații rare comparativ cu controalele și cu suprapunere genetică cu TSA și dizabilitatea intelectuală. Cu toate acestea, așa cum se va discuta în secțiunea următoare, suprapunerea genetică este extinsă între diferite tulburări neuropsihiatrice, iar legăturile genetice ale ADHD nu sunt restricționate la un grupare neurodezvoltativă.
Suprapunerea Genetică între ADHD și Alte Tulburări Neuropsihiatrice
Una dintre cele mai remarcabile descoperiri care au ieșit din GWAS este suprapunerea genetică extinsă pentru trăsăturile și tulburările biomedicale (27). Descoperirile GWAS ale ADHD nu fac excepție; ADHD a arătat corelații genetice pozitive semnificative cu o gamă largă de tulburări neuropsihiatrice, inclusiv schizofrenia, tulburarea bipolară, sindromul Tourette, tulburarea de anxietate și tulburarea depresivă majoră, și o corelație genetică negativă semnificativă cu anorexia nervoasă (15).
Tulburările neuropsihiatrice în general arată o pleiotropie puternică între ele, dar puțină suprapunere cu tulburările neurologice (28). ADHD arată, de asemenea, suprapunere genetică cu unele condiții fizice și trăsături (de exemplu, cancerul pulmonar, insomnia, migrena, indicele de masă corporală) precum și unele fenotipuri sociale și de mediu (de exemplu, realizările educaționale, comportamentele legate de fumat) (15).
Prin urmare, este clar că ADHD nu arată suprapunere genetică doar cu tulburările neurodezvoltative și că factorii de risc (de exemplu, varianta genică sau riscul de mediu, cum ar fi fumatul pentru cancerul pulmonar sau boala cardiacă) pentru tulburările complexe, inclusiv ADHD, nu oferă neapărat un mijloc bun de definire a granițelor diagnostice sau a grupărilor semnificative sau de luare a deciziilor de tratament. De exemplu, fumatul este un factor de risc pentru cancerul pulmonar, boala cardiacă și hipertensiunea - boli pe care nu le-am clasifica ca o singură boală sau le-am trata în același mod. ADHD arată pleiotropie cu schizofrenia, dar nu este indicat clinic să tratăm schizofrenia cu medicație stimulantă sau atomoxetină.
Aceste descoperiri recente ale GWAS despre pleiotropie nu sunt enorm de surprinzătoare având în vedere că studiile recente pe familie și gemeni au observat, de asemenea, suprapuneri familiale și genetice între ADHD și probleme neuropsihiatrice cu debut mai târziu, inclusiv schizofrenia, tulburarea bipolară (29) și tulburarea depresivă majoră (30), precum și auto-vătămarea deliberată (31), sinuciderea completată (31) și abuzul de alcool (32). Observația suprapunerii genetice în sine nu mai este o observație nouă. Mai degrabă, ar trebui să ne întrebăm, Care sunt motivele care stau la baza acestor corelații genetice? De exemplu, descoperirile GWAS dezvăluie că ADHD, în mod tipic o tulburare cu debut precoce, arată cea mai puternică corelație genetică cu tulburarea depresivă majoră (rg=0.42). Este aceasta pentru că ADHD are o relație biologică deosebit de strânsă cu depresia? Există dovezi limitate până în prezent pentru a susține această ipoteză. Reprezintă pleiotropia un efect de risc cauzal al ADHD asupra depresiei majore? În concordanță cu aceasta oferind o explicație parțială, unele studii sugerează că tratamentul ADHD reduce riscul de depresie viitoare (33). Cu toate acestea, tratamentele de primă linie pentru ADHD nu sunt eficace pentru depresia majoră. O altă ipoteză este că o proporție de persoane cu depresie majoră recurentă care sunt recrutați în GWAS sunt clasificați greșit și au ADHD nedepistat sau un istoric de ADHD. Aceasta necesită investigație. Acestea sunt toate ipoteze care pot fi testate prin designuri epidemiologice și metode genomice noi, printre alte designuri, pentru a disagrega pleiotropia (34) (de exemplu, randomizarea mendeliană, o metodă care folosește variante genetice identificate pentru a consolida inferența cauzală, deoarece designurile epidemiologice observaționale sunt predispuse la diverse părtiniri [35]). Un alt exemplu de testare a ipotezelor potențiale se referă la corelația genetică observată între ADHD și cancerul pulmonar. Acea legătură este, probabil, mediată de fumatul de țigări sau alte comportamente de risc mai degrabă decât ca urmare a pleiotropiei sau a tratamentului ADHD. Procesele biologice partajate par puțin probabile, deși nu sunt complet implauzibile (de exemplu, o predispoziție mai largă la procesele inflamatorii mai largi). Cu toate acestea, aceste ipoteze alternative necesită testare explicită.
Conceptualizarea ADHD-ului ca trăsătură și categorie
Studii pe gemeni și epidemiologice
Dintr-o perspectivă epidemiologică, ADHD poate fi văzut ca o trăsătură precum și o categorie; scoruri mai înalte sunt asociate cu rezultate adverse, fără discontinuitate la un punct de tăiere specific (8). Deși o categorie diagnostică pentru ADHD este utilă în practica clinică deoarece multe decizii clinice sunt de natură categorică (de exemplu, utilizând sau nu utilizând medicație), o înțelegere a structurii sale subiacente poate fi informativă pentru clinicieni și pacienți precum și cercetători.
Studiile pe gemeni au sugerat de mulți ani că ADHD pare să se afle la capătul unui continuum de risc genetic, cu aceleași riscuri genetice contribuind pe tot continuumul ADHD în populație (2), cu posibila excepție a celor care se află la capătul extrem de jos al continuumului (36). Aceste constatări, împreună cu studiile epidemiologice, au sugerat că ADHD ar putea fi văzut ca ceva asemănător hipertensiunii, unde tulburarea se află la capătul extrem al unui fenotip distribuit în mod continuu (adică, tensiunea arterială) care este prezent în întreaga populație.
Variante genetice comune
Descoperirile GWAS au adăugat în continuare la această dovadă. Două studii au folosit un set de date independent de descoperire GWAS al ADHD pentru a genera scoruri de risc poligenic al ADHD (PRS) - povara relativă a alelelor de risc genetice comune pentru ADHD purtate de un individ - în cohorte de populație din Regatul Unit (37) și Țările de Jos (38). Ambele au constatat că PRS-ul ADHD a prezis nivelurile de trăsături ADHD în populația generală. Un al treilea studiu din Regatul Unit (39) a observat în continuare că atunci când PRS-urile au fost derivate pentru o măsură a trăsăturii ADHD dintr-o cohortă bazată pe populație, acestea au prezis diagnosticul ADHD într-un eșantion independent de pacienți. Cel mai recent și cel mai mare GWAS al ADHD (15) a putut merge mai departe testând corelația genetică între diagnosticul ADHD la pacienți și o meta-analiză GWAS mare a măsurilor trăsăturilor ADHD în 17,666 de persoane europene din consorțiul EAGLE (40). Constatările sunt remarcabile în sensul că investigatorii au observat o corelație genetică de 0.94 între diagnosticul ADHD la pacienți și trăsăturile ADHD în cohortele bazate pe populație. În general, descoperirile genetice converg în a arăta că diagnosticul ADHD se află la capătul extrem al unei trăsături cantitative.
Cu toate acestea, riscul genetic pentru diagnosticul ADHD nu este exclusiv legat de o singură măsură a trăsăturii continuu distribuite a ADHD. De exemplu, un studiu pe cohortă bazat pe populație (41) a constatat că scorurile de risc genetic pentru ADHD au prezis multiple trăsături neurodezvoltative ale copilăriei, inclusiv comunicarea socială, abilitatea cognitivă sau IQ, limbajul și memoria de lucru, deși nu recunoașterea emoțiilor. Constatările despre memoria de lucru au fost recent replicate (42). Un alt studiu a constatat că scorurile de risc genetic pentru ADHD au prezis, de asemenea, iritabilitatea copilăriei (43). Aceste constatări ar putea pur și simplu reflecta din nou pleiotropia, cu aceleași gene contribuind la mecanismele biologice care, la rândul lor, contribuie la diferite trăsături ale copilăriei în populație. O interpretare alternativă pentru clinician și cercetător este că un diagnostic de ADHD ar putea fi conceptualizat ca extremul mai multor responsabilități sau dimensiuni. O viziune dimensională asupra ADHD care este susținută de responsabilități genetice care contribuie, de asemenea, la caracteristici cognitive ar fi în concordanță cu gândirea proiectului Criteriilor de Domeniu de Cercetare. Acest cadru ne încurajează să vedem ADHD și alte tulburări mintale ca dimensiuni care acoperă gama de la normal la anormal și cuprind multiple niveluri de informații (de exemplu, gene, circuite). Dacă ADHD se comportă ca o dimensiune, atunci aceasta are implicații pentru modul în care clinicienii văd persoanele cu simptome subliminare de ADHD, care vor fi discutate mai târziu.
Dezvoltare și viața adultă
Traiectorii ADHD
Deși nivelurile simptomelor ADHD scad de obicei odată cu vârsta, o proporție de persoane arată simptome persistent ridicate sau un diagnostic continuu în adolescență sau viața adultă (8). Studiile longitudinale pe gemeni (44) au observat toate că persistența ADHD este asociată cu o încărcătură genetică mai mare; un studiu care a folosit analiza curbei de creștere latentă pentru a examina traiectoriile individuale a sugerat în continuare că traiectoriile ADHD prin adolescență pot fi explicate de responsabilități genetice care sunt independente de cele care contribuie la nivelurile simptomelor de bază în copilărie (45). O investigație recentă pe cohortă bazată pe populație a folosit descoperirile GWAS ale ADHD pentru a evalua contribuția variantelor genetice comune ale ADHD la traiectoriile simptomelor ADHD între vârstele de 4 și 17 ani (46). PRS-urile ADHD au fost semnificativ mai mari la copiii din traiectoria persistentă decât la cei dintr-un grup cu simptome scăzute (raportul de șanse=1.31, IC 95%=1.13–1.51), un grup intermediar (raportul de șanse=1.22, IC 95%=1.01–1.47) și un grup ADHD limitat la copilărie (raportul de șanse=1.27, IC 95%=1.05–1.53). Interesant, deși eșantionul de descoperire GWAS al schizofreniei este mult mai mare și mai puternic decât GWAS-ul ADHD, PRS-urile schizofreniei și alte PRS-uri neuropsihiatrice nu au prezis persistența simptomelor ADHD. Acest lucru evidențiază faptul că există un grad de specificitate a descoperirilor genetice.
ADHD la Adulți
Alte studii genetice care au evaluat ADHD la adulți la persoane peste vârsta de 18 ani folosind designuri transversale susțin, de asemenea, sugestia că ADHD persistent are o încărcătură genetică mai mare. De exemplu, un studiu recent bazat pe registre din Suedia a observat un risc relativ mult mai mare de ADHD clinic recunoscut la frații celor care aveau ADHD la vârsta de 18 ani sau mai mari (raportul de hazard=11.49) decât la frații celor care aveau ADHD înainte de vârsta de 18 ani (raportul de hazard=4.68) (5).
Cu toate acestea, studiile pe gemeni despre ADHD la adulți au produs în mod repetat estimări foarte scăzute ale ereditabilității, în contrast cu estimările ereditabilității constant ridicate observate în studiile pe gemeni la copii. Explicația cea mai probabilă pentru aceasta este schimbarea informatorului de la părinte la auto-raportare în viața adultă, deoarece simptomele auto-raportate ale ADHD au fost găsite să arate o ereditabilitate scăzută chiar și la copii (47). Un studiu suedez pe registre (48), cu toate acestea, a găsit o ereditabilitate substanțială pentru ADHD pe tot parcursul vieții, inclusiv în viața adultă (h2=0.72, IC 95%=0.56–0.84). Aici, ADHD a fost definit pe baza fie a unui diagnostic ICD, fie a medicației prescrise pentru ADHD. Aceste constatări sugerează că, cu un diagnostic al clinician
ului, unde poate sunt utilizate evaluări clinice detaliate și criterii de afectare mai degrabă decât măsuri de auto-raportare prin chestionar, diferențele de dezvoltare în arhitectura genetică nu sunt la fel de pronunțate, cel puțin în ceea ce privește constatările studiilor pe gemeni.
Deși există eforturi internaționale de a asambla seturi de date mari pentru ADHD la adulți, până acum GWAS-urile nu au reușit să genereze loci semnificativi la nivel genomic, și studiile de variante rare (49, 50) vor necesita, de asemenea, dimensiuni mult mai mari ale eșantionului (51) înainte de a putea fi utilizate pentru a evalua în continuare diferențele de dezvoltare în arhitectura genetică a ADHD la nivel molecular (vezi referința 52 pentru o recenzie extensivă a geneticii ADHD la adulți).
Direcții de viitor
Mai multe descoperiri genetice, biologie și mediu
Secolul 21 a fost martorul descoperirii variantelor genetice rare și comune asociate cu ADHD și a rezolvat că arhitectura sa genetică implică un spectru de variație genetică în ceea ce privește frecvențele și dimensiunile efectului. Aceste descoperiri oferă deja un punct de plecare pentru obținerea de perspective asupra biologiei subiacente a ADHD (de exemplu, 18, 53) și pentru identificarea și evaluarea tratamentelor noi. Unele indicii despre tratament vin de la mutații rare - de exemplu, într-un studiu preliminar recent deschis, în orb, controlat cu placebo, al activatorului receptorului metabotropic de glutamat fasoracetam la 30 de adolescenți care poartă mutații mGluR (54). Există, de asemenea, un interes crescând în utilizarea datelor de asociere genomică largă pentru a evidenția candidații pentru repoziționarea medicamentelor în psihiatrie, dar până acum aceasta nu a fost aplicată ADHD (55). Cu toate acestea, va fi nevoie de mai multe lucrări pentru a investiga impacturile funcționale ale variantelor genetice asociate la nivelul moleculelor, celulelor, sistemelor și circuitelor neuronale, precum și impacturile lor asupra dezvoltării creierului, utilizând bioinformatica, precum și designuri experimentale. O altă observație este că, până acum, variantele genetice comune identificate explică doar o fracțiune relativ mică din ereditabilitatea ADHD (h2=0.22) (15) care a fost inferată din designurile tradiționale de studiu pe gemeni. Acest lucru sugerează că vor fi necesare studii suplimentare de descoperire genetică ADHD colaborative și mai mari pentru a detecta contribuții genetice suplimentare, împreună cu designuri epidemiologice robuste pentru a identifica factorii de risc de mediu cauzali. Așa-numita ereditabilitate a polimorfismului unic nucleotidic va fi întotdeauna o subestimare a ereditabilității reale, deoarece cuprinde doar loci genetici comuni detectați de GWAS care nu sunt neapărat cauzali, și nu include contribuțiile mutațiilor rare, factorii de risc de mediu, corelația genă-mediu sau interacțiunile. Strategii noi pot fi necesare pentru a lua în considerare mecanisme alternative plauzibile de risc care ar putea manifesta ca ereditabilitate - de exemplu, medii timpurii furnizate de părinți (56), inclusiv mediul prenatal. Literatura din ultimii 5 ani despre genetica ADHD a arătat avantajul enorm al registrelor de pacienți naționale informatizate genetic, și acestea vor rămâne o resursă inestimabilă pentru investigarea multora dintre întrebările ridicate în această recenzie.
Implicațiile suprapunerii genetice
Descoperirile genetice recente evidențiază suprapunerea puternică între ADHD, TSA și dizabilitatea intelectuală. Într-adevăr, în ceea ce privește mutațiile rare, până acum, nu a fost posibil să se distingă între ADHD și TSA (22), deci eliminarea criteriilor anterioare de excludere diagnostică pentru ADHD în prezența TSA este o schimbare binevenită în DSM-5. Cu toate acestea, caracteristicile clinice și tratamentele acestor tulburări sunt foarte diferite. Ce determină aceste diferențe este o altă întrebare crucială de cercetare următoare (Figura 1). De obicei, acestea sunt tulburări cu debut precoce. O posibilă contribuție la diferențe este variația în expunerile de mediu prenatal; o altă posibilitate este variantele genetice comune de fond. De exemplu, scorurile de risc genetice comune pentru ADHD prezic o abilitate cognitivă și realizări educaționale mai scăzute, în timp ce variantele genetice comune pentru TSA prezic o cogniție și realizări educaționale mai înalte (57). Lecțiile din descoperirile genetice despre suprapunerile diagnostice puternice sunt la timp pentru clinicieni și în special pentru furnizorii de servicii care tind să fie specifice diagnosticului (de exemplu, doar TSA), mai ales având în vedere reticența istorică despre diagnosticarea ADHD în contextul TSA sau dizabilității intelectuale. Acest lucru începe să fie recunoscut. De exemplu, în 2017 în Țara Galilor, o națiune de 3 milioane, clinicile multidisciplinare de neurodezvoltare ale copilului informate de descoperirile recente au fost stabilite și au înlocuit căile de evaluare specifice pentru ADHD și TSA.
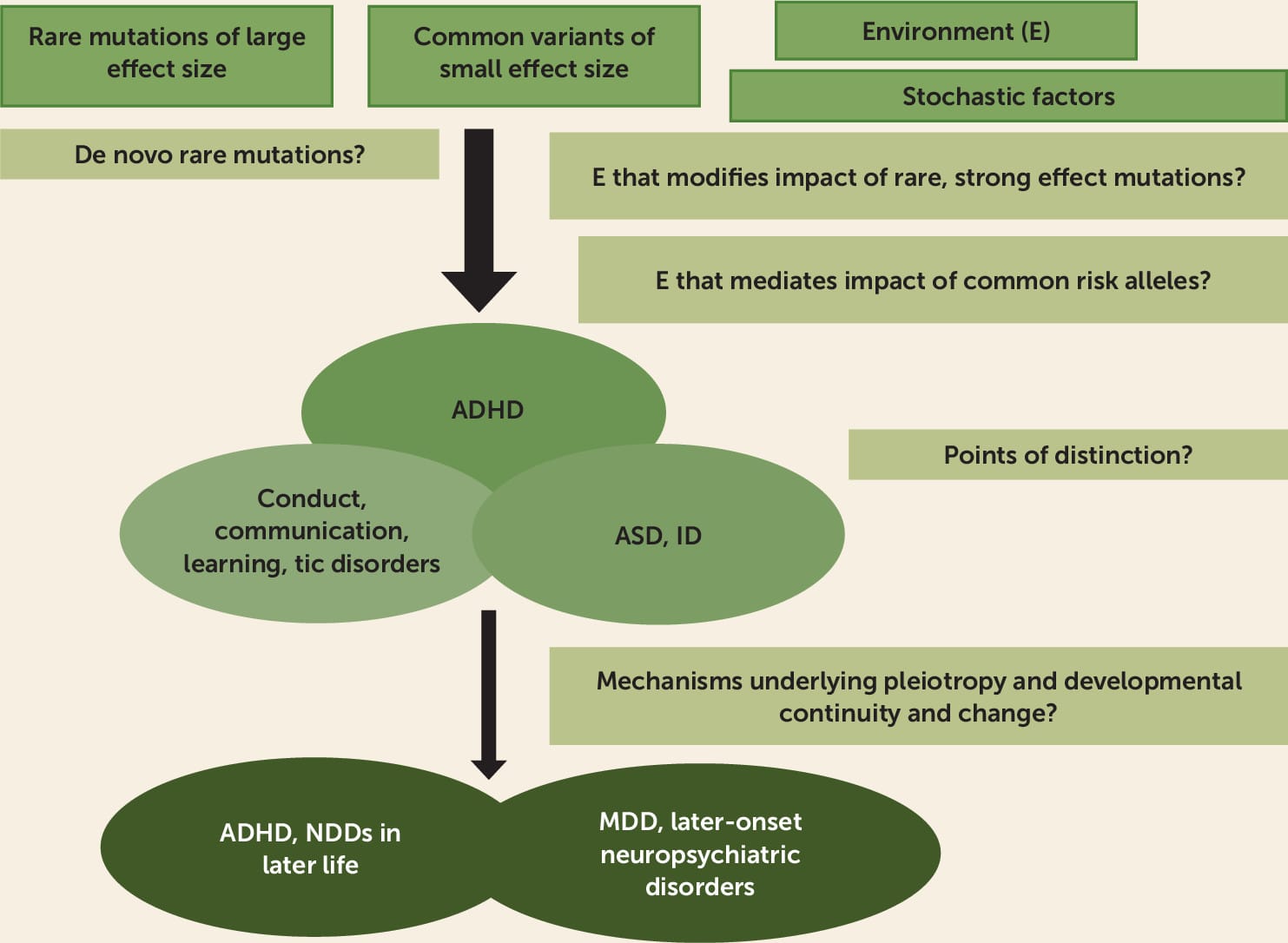
În ultimii 5 ani, GWAS-urile au arătat suprapunere genetică între multiple tulburări. ADHD arată o pleiotropie extinsă care este deosebit de proeminentă cu tulburarea depresivă majoră, dar riscurile genetice arată, de asemenea, o anumită specificitate, deoarece doar PRS-urile ADHD par să prezică persistența ADHD (46). În următorii 5 ani, eforturile trebuie să se concentreze pe disagregarea acestei pleiotropii și testarea ipotezelor alternative folosind metode care sunt capabile să distingă relațiile cauzale, subtipurile diferite de ADHD și clasificarea greșită de la pleiotropie (de exemplu, utilizând randomizarea mendeliană și alte metode similare). Acest lucru este important deoarece explicațiile diferite vor avea implicații clinice diverse (Figura 1).
Continuumul dezvoltării ADHD
Descoperirile genetice au confirmat viziunea epidemiologică a ADHD ca fiind la capătul extrem al unui continuum (sau mai multe continui) și au început să evidențieze importanța adoptării unei perspective dezvoltative (45, 46). Finanțatorii și organele de etică trebuie să recunoască că studiile dezvoltative necesită urmărire longitudinală și că acest lucru este costisitor și consumator de timp, dar în mod științific inestimabil. În acest sens, designurile de cohortă de populație longitudinală sunt atractive pentru studiile genetice informativ dezvoltative, deoarece, spre deosebire de datele registrelor de pacienți, acestea implică evaluări bazate pe trăsături; cu toate acestea, atracția nonaleatorie este o problemă, iar persoanele cu boli severe (la extremele dimensiunilor) sunt subreprezentați. Dacă ADHD este o trăsătură, asemănătoare cu tensiunea arterială, atunci eșantioanele de sănătate publică sau bazate pe populație și abordările pot fi integrate cu cercetarea tradițională genetică pe pacienți. Acest lucru începe să se întâmple. Conceptualizarea ADHD ca atât o trăsătură, cât și o tulburare este relevantă pentru clinicieni în sensul că majoritatea recunosc natura oarecum arbitrară a punctului de tăiere diagnostic și întâlnesc frecvent cazuri subliminare. Prezența unui continuum subiacent înseamnă că probleme precum definirea limitei pentru afectare și tratament nu sunt simple. De exemplu, punctul de tăiere pentru definirea hipertensiunii s-a schimbat în timp, iar ghidurile de hipertensiune din unele țări ajustează punctul de tăiere pentru boala comorbidă (de exemplu, boala renală cronică).
Testarea genetică
Având în vedere descoperirile genetice recente, care sunt implicațiile pentru testarea genetică în ADHD? Implicațiile pentru clinicieni sunt duble. În primul rând, rudele persoanelor cu ADHD, inclusiv părinții lor, sunt la un risc crescut de o gamă de tulburări neurodezvoltative (de exemplu, ADHD, TSA, dificultăți de învățare) precum și alte boli neuropsihiatrice (cel mai frecvent tulburarea depresivă majoră) care ar putea avea un impact asupra evaluării, livrării tratamentului sau eficacității tratamentului. În prezent, deși mutațiile rare detectate au dimensiuni mari ale efectului, testarea de rutină în ADHD nu este recomandată, deși ghidurile pentru astfel de teste în setări clinice s-au extins acum în multe țări pentru a include dizabilitatea intelectuală ușoară și, în Statele Unite, TSA. Nu a fost demult când dizabilitatea intelectuală ușoară era considerată în principal de origine socioculturală, deci aceasta reprezintă o schimbare substanțială în practica clinică internațională. Există puține dovezi empirice care să ne ghideze cu privire la ce ar trebui să se întâmple pentru ADHD. Un studiu mai vechi a arătat că rata sindroamelor stabilite era suficient de scăzută în ADHD încât testarea genetică nu este justificată la persoanele fără dizabilitate intelectuală (58). Cu toate acestea, acel studiu precede metodele curente de detectare a anomaliilor genomice, și o problemă crucială este cât de grav afectați neurodezvoltativ sunt grupurile țintă de pacienți, mai ales având în vedere că ADHD este relativ comun. Dacă testarea genetică în setări clinice se va extinde la tulburările neuropsihiatrice, cum ar fi ADHD și schizofrenia, rămâne de văzut, dar pe măsură ce costurile scad și se câștigă mai multe cunoștințe despre cauzalitatea diferitelor mutații, în opinia mea, practica clinică este probabil să se schimbe în următorul deceniu - și mai devreme dacă unele dintre aceste mutații rare se dovedesc a avea implicații de tratament sau prognostice sau sunt acționabile medical.
Utilitatea clinică a variantelor genetice de risc comun pentru prezicerea ADHD este mai puțin sigură, deoarece puterea lor predictivă este slabă și efectele de risc sunt definite în raport cu o populație mai degrabă decât un individ. Este posibil în viitor că combinarea informațiilor despre scorurile de risc genetice comune și istoricul familial (59) va fi utilă pentru stratificarea pacienților în scopul tratamentului sau prognosticului - de exemplu, în identificarea celor care sunt la un risc crescut de psihoză viitoare sau în ghidarea tratamentului. În prezent, cu toate acestea, aceste idei rămân în domeniul întrebărilor de cercetare care trebuie răspunse. Deși există un interes comercial mare în farmacogenomică, în prezent nu există dovezi științifice care să susțină astfel de teste în ADHD. Nici variantele genetice comune, nici cele rare nu au fost găsite a fi asociate în mod robust cu răspunsul la tratament în ADHD, și vor fi necesare studii foarte mari pentru a detecta loci semnificativi la nivel genomic.
În rezumat, multe descoperiri genetice noi despre ADHD au apărut și vor continua să apară în secolul 21. Astfel de descoperiri sunt, în opinia mea, de interes și relevanță pentru un câmp științific larg, inclusiv neuroștiințe, științe dezvoltative și epidemiologie populațională, precum și pentru clinicieni, deoarece contribuie la conceptualizarea noastră despre ADHD și pot modela următorii 5 ani de cercetare și practică clinică.
Bibliografie (click pentru a expanda)
Andrews, G., Pine, D. S., Hobbs, M. J., Anderson, T., & Sunderland, M. (2009). Neurodevelopmental disorders: Cluster 2 of the proposed meta-structure for DSM-V and ICD-11. Psychological Medicine. https://doi.org/10.1017/s0033291709990274
Anttila, V., Bulik-Sullivan, B., Finucane, H., Brás, J., Duncan, L., Escott‐Price, V., Falcone, G. J., Gormley, P., Malik, R., Patsopoulos, Nikolaos A, Ripke, S., Walters, R., Wei, Z., Yu, D., Lee, P., Metastroke, Ocd, Breen, G., Bulik, C. M., & Daly, M. J. (2016). Analysis of shared heritability in common disorders of the brain. https://doi.org/10.1101/048991
Bastain, T. M., Lewczyk, C. M., Sharp, W., James, R. S., Long, R. T., Eagen, P. B., Ebens, C. L., Meck, J., Chan, W., Sidransky, E., Rapoport, J. L., & Xavier, C. F. (2002). Cytogenetic abnormalities in attention-deficit/hyperactivity disorder. Journal of the American Academy of Child & Adolescent Psychiatry. https://doi.org/10.1097/00004583-200207000-00012
Chang, Z., D’Onofrio, B. M., Quinn, P. D., Lichtenstein, P., & Larsson, H. (2016). Medication for attention-deficit/hyperactivity disorder and risk for depression: A nationwide longitudinal cohort study. Biological Psychiatry. https://doi.org/10.1016/j.biopsych.2016.02.018
Chang, Z., Lichtenstein, P., Asherson, P., & Larsson, H. (2013). Developmental twin study of attention problems. Jama Psychiatry. https://doi.org/10.1001/jamapsychiatry.2013.287
Chen, Q., Brikell, I., Lichtenstein, P., Serlachius, E., Kuja‐Halkola, R., Sandin, S., & Larsson, H. (2016). Familial aggregation of Attention‐deficit/Hyperactivity disorder. Journal of Child Psychology and Psychiatry. https://doi.org/10.1111/jcpp.12616
Chen, T.-J., Ji, C., Wang, S., Lichtenstein, P., Larsson, H., & Chang, Z. (2015). Genetic and environmental influences on the relationship between ADHD symptoms and internalizing problems: A chinese twin study. American Journal of Medical Genetics Part B Neuropsychiatric Genetics. https://doi.org/10.1002/ajmg.b.32411
Demontis, D., Walters, R., Martin, J., Mattheisen, M., Als, T. D., Agerbo, E., Belliveau, R., Bybjerg‐Grauholm, J., Bækvad-Hansen, M., Cerrato, F., Chambert, K., Churchhouse, C., DuMont, A. L., Eriksson, N., Gandal, M. J., Goldstein, J. I., Grove, J., Hansen, C., Hauberg, Mads E, & Hollegaard, Mads V. (2017). Discovery of the first genome-wide significant risk loci for ADHD. https://doi.org/10.1101/145581
Derks, E. M., Vink, J. M., Willemsen, G., van, & Boomsma, D. I. (2014). Genetic and environmental influences on the relationship between adult ADHD symptoms and self-reported problem drinking in 6024 dutch twins. Psychological Medicine. https://doi.org/10.1017/s0033291714000361
Elia, J., Glessner, J. T., Wang, K., Takahashi, N., Shtir, C., Hadley, D., Sleiman, P., Zhang, H., Kim, C., Robison, R., Lyon, G. J., Flory, J., Bradfield, J. P., Imieliński, M., Hou, C., Frackelton, E. C., Chiavacci, R. M., Sakurai, T., Rabin, C., & Middleton, F. A. (2011). Genome-wide copy number variation study associates metabotropic glutamate receptor gene networks with attention deficit hyperactivity disorder. Nature Genetics. https://doi.org/10.1038/ng.1013
Elia, J., Ungal, G., Kao, C., Ambrosini, A., Jesus-Rosario, N. D., Larsen, L., Chiavacci, R. M., Wang, T., Kurian, C., Titchen, K., Sykes, B. D., Hwang, S. Y., Kumar, B., Potts, J., Davis, J., Jeffrey, M. J., Slattery, E., Moorthy, G. S., Zuppa, A. F., & Weller, A. E. (2018). Fasoracetam in adolescents with ADHD and glutamatergic gene network variants disrupting mGluR neurotransmitter signaling. Nature Communications. https://doi.org/10.1038/s41467-017-02244-2
Faraone, S. V., Ghirardi, L., Kuja‐Halkola, R., Lichtenstein, P., & Larsson, H. (2017). The familial co-aggregation of attention-deficit/hyperactivity disorder and intellectual disability: A register-based family study. Journal of the American Academy of Child & Adolescent Psychiatry. https://doi.org/10.1016/j.jaac.2016.11.011
Fk, S., Rk, W., Singh, T., Em, W., Lescai, F., Demontis, D., Ja, K., Grove, J., Stevens, C., Bybjerg‐Grauholm, J., Bækvad‐Hansen, M., Ds, P., Jb, M., Nordentoft, M., Mors, O., Eb, R., Dm, H., Tm, W., Pb, M., & Bm, N. (2018). ASD and ADHD have a similar burden of rare protein-truncating variants. https://doi.org/10.1101/277707
Ghirardi, L., Brikell, I., Kuja‐Halkola, R., Freitag, C. M., Franke, B., Asherson, P., Lichtenstein, P., & Larsson, H. (2017). The familial co-aggregation of ASD and ADHD: A register-based cohort study. Molecular Psychiatry. https://doi.org/10.1038/mp.2017.17
Greven, C. U., Merwood, A., Jolanda, Claire, Rommelse, N., & Buitelaar, J. K. (2015). The opposite end of the attention deficit hyperactivity disorder continuum: Genetic and environmental aetiologies of extremely low ¡scp¿ADHD¡/Scp¿ traits. Journal of Child Psychology and Psychiatry. https://doi.org/10.1111/jcpp.12475
Groen-Blokhuis, M. M., Middeldorp, C. M., Kan, K. J., Abdellaoui, A., van, Ehli, E. A., Davies, G. E., Scheet, P., Xiao, X., Hudziak, J. J., Hottenga, Jouke Jan, M, N. B., & Boomsma, D. I. (2014). Attention-deficit/hyperactivity disorder polygenic risk scores predict attention problems in a population-based sample of children. Journal of the American Academy of Child & Adolescent Psychiatry. https://doi.org/10.1016/j.jaac.2014.06.014
Grove, J., Ripke, S., Als, T. D., Mattheisen, M., Walters, R., Won, H., Pallesen, J., Agerbo, E., Andreassen, O. A., Anney, R., Belliveau, R., Bettella, F., Buxbaum, J. D., Bybjerg‐Grauholm, J., Bækvad-Hansen, M., Cerrato, F., Chambert, K., Christensen, J. H., Churchhouse, C., & Dellenvall, K. (2017). Common risk variants identified in autism spectrum disorder. https://doi.org/10.1101/224774
Huang, A., Yu, D., Davis, L. K., Sul, J. H., Tsetsos, F., Ramensky, V., Zelaya, I., Ramos, E. M., Osiecki, L., Chen, J., McGrath, L. M., Illmann, C., Sandor, P., Barr, C. L., Grados, M. A., Singer, H. S., Nöthen, M. M., Hebebrand, J., King, R. A., & Dion, Y. (2017). Rare copy number variants in NRXN1 and CNTN6 increase risk for tourette syndrome. Neuron. https://doi.org/10.1016/j.neuron.2017.06.010
Jarick, I., Volckmar, A., Pütter, C., Pechlivanis, S., Trang, Dauvermann, M. R., Beck, S., Albayrak, Ö., Scherag, S., Gilsbach, S., Cichon, S., Hoffmann, P., Degenhardt, F., Nöthen, M. M., Schreiber, S., Wichmann, H., Jöckel, K., Heinrich, J., Carla, & Faraone, S. V. (2012). Genome-wide analysis of rare copy number variations reveals PARK2 as a candidate gene for attention-deficit/hyperactivity disorder. Molecular Psychiatry. https://doi.org/10.1038/mp.2012.161
Kong, A., Þorleifsson, G., Frigge, M. L., Vilhjálmsson, Bjarni J, Young, A. I., Thorgeirsson, Thorgeir E, Benónísdóttir, S., Oddsson, Á., Halldórsson, Bjarni V, Másson, G., Guðbjartsson, Daníel F, Helgason, A., Björnsdóttir, G., Þorsteinsdóttir, U., & Stefánsson, K. (2018). The nature of nurture: Effects of parental genotypes. Science. https://doi.org/10.1126/science.aan6877
Larsson, H., Chang, Z., D’Onofrio, B. M., & Lichtenstein, P. (2013). The heritability of clinically diagnosed attention deficit hyperactivity disorder across the lifespan. Psychological Medicine. https://doi.org/10.1017/s0033291713002493
Larsson, H., Rydén, E., Boman, M., Långström, N., Lichtenstein, P., & Landén, M. (2013). Risk of bipolar disorder and schizophrenia in relatives of people with attention-deficit hyperactivity disorder. The British Journal of Psychiatry. https://doi.org/10.1192/bjp.bp.112.120808
Lionel, A. C., Crosbie, J., Barbosa, N., Goodale, T., Thiruvahindrapuram, B., Rickaby, J., Gazzellone, M. J., Carson, A. R., Howe, J., Wang, Z., Wei, J., Stewart, A. F. R., Roberts, R., McPherson, R., Fiebig, A., Franke, A., Schreiber, S., Zwaigenbaum, L., Fernandez, B. A., & Roberts, W. (2011). Rare copy number variation discovery and cross-disorder comparisons identify risk genes for ADHD. Science Translational Medicine. https://doi.org/10.1126/scitranslmed.3002464
Ljung, T., Chen, Q., Lichtenstein, P., & Larsson, H. (2014). Common etiological factors of attention-deficit/hyperactivity disorder and suicidal behavior. Jama Psychiatry. https://doi.org/10.1001/jamapsychiatry.2014.363
Martin, J., Hamshere, M. L., Stergiakouli, E., O’Donovan, M. C., & Thapar, A. (2014a). Genetic risk for attention-deficit/hyperactivity disorder contributes to neurodevelopmental traits in the general population. Biological Psychiatry. https://doi.org/10.1016/j.biopsych.2014.02.013
Martin, J., Hamshere, M. L., Stergiakouli, E., O’Donovan, M. C., & Thapar, A. (2014b). Neurocognitive abilities in the general population and composite genetic risk scores for Attention‐deficit hyperactivity disorder. Journal of Child Psychology and Psychiatry. https://doi.org/10.1111/jcpp.12336
Martin, J., Walters, R., Demontis, D., Mattheisen, M., Lee, S., Robinson, E., Brikell, I., Ghirardi, L., Larsson, H., Lichtenstein, P., Eriksson, N., Workgroup, iPSYCH–Broad Adhd, Werge, T., Mortensen, P. B., Mors, O., Nordentoft, M., Hougaard, D. M., Bybjerg‐Grauholm, J., Wray, N. R., & Franke, B. (2017). A genetic investigation of sex bias in the prevalence of attention deficit hyperactivity disorder. https://doi.org/10.1101/154088
Martinez-Badía, J. (2015). Who says this is a modern disorder? The early history of attention deficit hyperactivity disorder. World Journal of Psychiatry. https://doi.org/10.5498/wjp.v5.i4.379
Middeldorp, C. M., Hammerschlag, A. R., Ouwens, Klaasjan G, Groen-Blokhuis, M. M., Pourcain, Beaté St, Greven, C. U., Pappa, I., Carla, Ang, W., Nolte, I. M., Vilor‐Tejedor, N., Bacelis, J., Ebejer, J. L., Zhao, H., Davies, G. E., Ehli, E. A., Evans, D. M., Fedko, Iryna O, Guxens, M., & Hottenga, J. (2016). A genome-wide association meta-analysis of attention-deficit/hyperactivity disorder symptoms in population-based pediatric cohorts. Journal of the American Academy of Child & Adolescent Psychiatry. https://doi.org/10.1016/j.jaac.2016.05.025
Nigg, J. T., Gustafsson, H., Karalunas, S. L., Ryabinin, P., McWeeney, S. K., Faraone, S. V., Mooney, M. A., Fair, D. A., & Wilmot, B. (2018). Working memory and vigilance as multivariate endophenotypes related to common genetic risk for attention-deficit/hyperactivity disorder. Journal of the American Academy of Child & Adolescent Psychiatry. https://doi.org/10.1016/j.jaac.2017.12.013
Pickrell, J. K., Berisa, T., Liu, J. Z., Ségurel, L., Tung, J. Y., & Hinds, D. A. (2016). Detection and interpretation of shared genetic influences on 42 human traits. Nature Genetics. https://doi.org/10.1038/ng.3570
Pingault, J., Viding, E., Galèra, C., Greven, C. U., Zheng, Y., Plomin, R., & Rijsdijk, F. (2015). Genetic and environmental influences on the developmental course of attention-deficit/hyperactivity disorder symptoms from childhood to adolescence. Jama Psychiatry. https://doi.org/10.1001/jamapsychiatry.2015.0469
Ramos-Quiroga, Josep Antoni, Sánchez-Mora, C., Casas, M., Garcia-Martínez, I., Bosch, R., Nogueira, M., Corrales, M., Palomar, G., Vidal, R., Coll-Tané, M., Bayés, M., Cormand, B., & Ribasés, M. (2014). Genome-wide copy number variation analysis in adult attention-deficit and hyperactivity disorder. Journal of Psychiatric Research. https://doi.org/10.1016/j.jpsychires.2013.10.022
Rees, E., Kendall, K., Pardiñas, A. F., Legge, S. E., Pocklington, A., Escott‐Price, V., MacCabe, J. H., Collier, D. A., Holmans, P., O’Donovan, M. C., Walters, J., & Kirov, G. (2016). Analysis of intellectual disability copy number variants for association with schizophrenia. Jama Psychiatry. https://doi.org/10.1001/jamapsychiatry.2016.1831
Riglin, L., Collishaw, S., Thapar, A. K., Dalsgaard, S., Langley, K., Smith, G. D., Stergiakouli, E., Maughan, B., O’Donovan, M., & Thapar, A. (2016). Association of genetic risk variants with attention-deficit/hyperactivity disorder trajectories in the general population. Jama Psychiatry. https://doi.org/10.1001/jamapsychiatry.2016.2817
Riglin, L., Eyre, O., Cooper, M., Collishaw, S., Martin, J., Langley, K., Leibenluft, E., Stringaris, A., Thapar, A., Maughan, B., & O’Donovan, M. C. (2017). Investigating the genetic underpinnings of early-life irritability. Translational Psychiatry. https://doi.org/10.1038/tp.2017.212
Schneider, M., Debbané, M., Bassett, A. S., Chow, E. W. C., Lun, W., Marianne, B., Owen, M. J., Murphy, K. C., Niarchou, M., Kates, W. R., Antshel, K. M., Fremont, W., McDonald‐McGinn, D. M., Gur, R. E., Zackai, E. H., Vorstman, J., Duijff, Sasja N, Klaassen, P., Swillen, A., & Gothelf, D. (2014). Psychiatric disorders from childhood to adulthood in 22q11.2 deletion syndrome: Results from the international consortium on brain and behavior in 22q11.2 deletion syndrome. American Journal of Psychiatry. https://doi.org/10.1176/appi.ajp.2013.13070864
Smith, G. D., & Hemani, G. (2014). Mendelian randomization: Genetic anchors for causal inference in epidemiological studies. Human Molecular Genetics. https://doi.org/10.1093/hmg/ddu328
So, H., Chau, C. K., Chiu, W.-T., Ho, K.-S., Lo, C.-P., Yim, S. H.-Y., & Sham, P.-C. (2017). Analysis of genome-wide association data highlights candidates for drug repositioning in psychiatry. Nature Neuroscience. https://doi.org/10.1038/nn.4618
Stergiakouli, E., Martin, J., Hamshere, M. L., Langley, K., Evans, D. M., Pourcain, Beaté St, Timpson, N. J., Owen, M. J., O’Donovan, M., Thapar, A., & Smith, G. D. (2015). Shared genetic influences between attention-deficit/hyperactivity disorder (ADHD) traits in children and clinical ADHD. Journal of the American Academy of Child & Adolescent Psychiatry. https://doi.org/10.1016/j.jaac.2015.01.010
Stessman, H. A. F., Xiong, B., Coe, B. P., Wang, T., Hoekzema, K., Fencková, M., Kvarnung, M., Gerdts, J., Trinh, S., Cosemans, N., Vives, L., Lin, J. D., Turner, T. N., Santen, G. W. E., Ruivenkamp, C., Kriek, M., Haeringen, A. van, Aten, E., Friend, K., & Liebelt, J. (2017). Targeted sequencing identifies 91 neurodevelopmental-disorder risk genes with autism and developmental-disability biases. Nature Genetics. https://doi.org/10.1038/ng.3792
Sullivan, P. F., Agrawal, A., Bulik, C. M., Andreassen, O. A., Børglum, Anders D, Breen, G., Cichon, S., Edenberg, H. J., Faraone, S. V., Gelernter, J., Mathews, C. A., Nievergelt, C. M., Smoller, J. W., & O’Donovan, M. (2018). Psychiatric genomics: An update and an agenda. American Journal of Psychiatry. https://doi.org/10.1176/appi.ajp.2017.17030283
Thapar, A., Cooper, M., Eyre, O., & Langley, K. (2012). Practitioner review: What have we learnt about the causes of ADHD? Journal of Child Psychology and Psychiatry. https://doi.org/10.1111/j.1469-7610.2012.02611.x
Thapar, A., Cooper, M., & Rutter, M. (2017). Neurodevelopmental disorders. The Lancet Psychiatry. https://doi.org/10.1016/s2215-0366(16)30376-5
Thapar, A., Pine, D. S., Leckman, J. F., Scott, S., Snowling, M. J., & Taylor, E. (2015). Neurodevelopmental disorders. https://doi.org/10.1002/9781118381953.ch3
Tuvblad, C., Zheng, M., Raine, A., & Baker, L. A. (2008). A common genetic factor explains the covariation among ADHD ODD and CD symptoms in 9–10 year old boys and girls. Journal of Abnormal Child Psychology. https://doi.org/10.1007/s10802-008-9278-9
Vernes, S. C., Newbury, D. F., Abrahams, B. S., Winchester, L., Nicod, J., Groszer, M., Barradas, E., Oliver, P. L., Davies, K. E., Geschwind, D. H., Monaco, A. P., & Fisher, S. E. (2008). A functional genetic link between distinct developmental language disorders. New England Journal of Medicine. https://doi.org/10.1056/nejmoa0802828
Weiner, D. J., Wigdor, E. M., Ripke, S., Walters, R., Kosmicki, J. A., Grove, J., Samocha, K. E., Goldstein, J. I., Okbay, A., Bybjerg‐Grauholm, J., Werge, T., Hougaard, D. M., Taylor, J., Skuse, D., Devlin, B., Anney, R., Sanders, S., Bishop, S., Mortensen, P. B., & Børglum, Anders D. (2017). Polygenic transmission disequilibrium confirms that common and rare variation act additively to create risk for autism spectrum disorders. Nature Genetics. https://doi.org/10.1038/ng.3863
Williams, N., Franke, B., Mick, E., Anney, R., Freitag, C. M., Gill, M., Thapar, A., O’Donovan, M. C., Holmans, P. A., Kent, L., Middleton, F. A., Zhang‐James, Y., Liu, L., Meyer, J., Nguyen, T. T., Romanos, J., Romanos, M., Seitz, C., Renner, T., & Walitza, S. (2012). Genome-wide analysis of copy number variants in attention deficit hyperactivity disorder: The role of rare variants and duplications at 15q13.3. American Journal of Psychiatry. https://doi.org/10.1176/appi.ajp.2011.11060822
Williams, N., Zaharieva, I., Martin, A. K., Langley, K., Mantripragada, Kiran Kumar, Fossdal, R., Stefánsson, H., Stefánsson, K., Magnússon, P., Guðmundsson, Ólafur Ó, Gústafsson, Ó., Holmans, P. A., Owen, M. J., & Thapar, A. (2010). Rare chromosomal deletions and duplications in attention-deficit hyperactivity disorder: A genome-wide analysis. The Lancet. https://doi.org/10.1016/s0140-6736(10)61109-9
Zayats, T., Jacobsen, K. K., Kleppe, R., Jacob, C., Kittel‐Schneider, S., Ribasés, M., Ramos-Quiroga, Josep Antoni, Richarte, V., Casas, M., Mota, N. R., Grevet, Eugênio H, Klein, M., Corominas, J., Bralten, J., Galesloot, Tessel E, Vasquez, A., Herms, S., Aj, F., Larsson, H., & Breen, G. (2016). Exome chip analyses in adult attention deficit hyperactivity disorder. Translational Psychiatry. https://doi.org/10.1038/tp.2016.196
Alte opțiuni de donații se regăsesc AICI.
Dacă sunteți o persoană în căutare de îndrumare pentru dvs. și/sau pentru o altă persoană aflată în grija dvs., este esențial să consultați direct un medic sau un specialist în sănătate mintală calificat pentru a primi sfaturi personalizate și adaptate specificităților situației personale. Această abordare asigură că veți beneficia de o îndrumare profesională înțeleaptă și cu adevărat relevantă pentru nevoile dvs. unice. Puteți găsi o listă de recomandări din comunitate pe site-ul DoctorADHD.com
Dacă sunteți un profesionist, accentuăm importanța angajamentului dvs. într-un proces continuu de formare profesională și educație, precum și necesitatea obținerii de supervizare clinică adecvată.